
Contenu
- Nombre d'électrons dans la coquille de valence
- Étape 1
- Étape 2
- Étape 3
- Étape 4
- Structure de Lewis
- Étape 1
- Étape 2
- Étape 3
- Charge formelle de chaque atome
- Étape 1
- Étape 2
- Étape 3
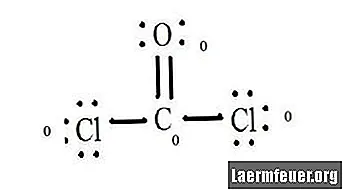
Lors de la détermination de la charge formelle d'une molécule telle que CoCl2 (gaz phosgène), il est nécessaire de connaître le nombre d'électrons dans la couche de valence de chaque atome et la structure de Lewis de la molécule.
Nombre d'électrons dans la coquille de valence
Étape 1
Recherchez chaque atome dans le tableau périodique des éléments pour déterminer le nombre d'électrons dans la couche de valence.
Étape 2
Rappelez-vous que deux électrons sont au premier sous-niveau s, deux au deuxième sous-niveau s, six électrons au premier sous-niveau p, etc. Rappelez-vous: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
Étape 3
Frappez la charge. Si la molécule est un ion, ajoutez ou soustrayez un ou plusieurs électrons du total pour arriver à la charge finale.
Étape 4
Pour CoCl2 (gaz phosgène): C = 4; O = 6; Cl = 7. La molécule n'est pas ionisée et a une charge neutre. Par conséquent, le nombre total d'électrons dans la couche de valence est de 4 + 6 + (7x2) = 24.
Structure de Lewis
Étape 1
Voir le diagramme de la structure de Lewis du CoCl2 (gaz phosgène). La structure de Lewis représente la structure la plus stable et la plus probable pour la molécule. Les atomes sont tirés avec des électrons de valence appariés; des liaisons sont formées entre des électrons libres pour satisfaire la règle de l'octet.
Étape 2

Dessinez chaque atome et ses électrons de valence, puis formez des liaisons au besoin.
Étape 3
Les atomes de chlorure partagent des liaisons simples avec la molécule de carbone, tandis que l'atome d'oxygène forme une double liaison avec le carbone. Chaque atome de la structure finale satisfait la règle de l'octet et a huit électrons dans la coquille de valence, permettant la stabilité moléculaire.
Charge formelle de chaque atome
Étape 1
Comptez les paires sans électrons de chaque atome dans la structure de Lewis. Chaque atome se voit attribuer un électron de chaque liaison à laquelle il participe. Ajoutez ces chiffres. Dans CoCl2: C = 0 paire libre plus 4 électrons de liaisons = 4 électrons. O = 4 électrons de paires libres plus 2 électrons de liaisons = 6 électrons. Cl = 6 électrons de paires libres plus un électron d'une liaison avec C = 7 électrons.
Étape 2
Soustrayez la quantité du nombre d'électrons dans la coquille de valence dans l'atome non lié. Le résultat est la charge formelle de chaque atome. Dans CoCl2: C = 4 électrons de valence (ev) dans l'atome non lié moins 4 électrons désignés dans la structure de Lewis (LS) = 0 charge formelle O = 6 ev - 6 LS = 0 charge formelle Cl = 7 ev - 7 LS = 0 cargaison formelle
Étape 3
Lors de l'écriture, placez ces charges à proximité des atomes de la structure de Lewis. Si la molécule a une charge totale, placez la structure de Lewis entre parenthèses avec la charge écrite à l'extérieur dans le coin supérieur droit.